Важной особенностью кристаллических структур является то, что какой бы атом мы не рассматривали в данной структуре, расположение соседних с ним атомов по отношению к нему всегда будет идентичным. Обычно металлические и ионные твердые тела при комнатной температуре находятся в кристаллическом состоянии. Любое твердое вещество, в котором атомы расположены несимметрично, называется аморфным.
Кристаллические структуры.
Одним из простейших расположений атомов в пространстве является куб, в котором атомы занимают положения в восьми углах. Снова используя модель шаров или сфер для обозначения атомов, можно представить себе кубическое расположение атомов (Рис. 1.3.10а). Каждая сфера соприкасается со своим ближайшим соседом, таким образом, длина стороны куба равна диаметру атома. Если рассматривать простой куб, состоящий только из части атомов внутри этого куба (Рис. 1.3.10Ь), то можно узнать, что представляет собой элементарная ячейка. Устанавливая элементарные ячейки одна на другую, можно построить структуру трехмерного (объемного) твердого тела.
В пределах структурной единицы атомы не нахо-
дятся в неподвижном состоянии — они совершают колебательные движения. Доля пространства, занимаемая атомами, называется фактором упаковки, и ее легко рассчитать.
Если предположить, что длина каждой стороны куба составляет 2а, то объем элементарной ячейки.
3.
составит 8а . Соответственно, радиус каждой сферы.
3.
должен быть равным а, а объем сферы — 4/Зка . На самом деле, вклад каждой сферы в элементарную ячейку составляет всего 1/8 часть от ее объема, но, поскольку эта ячейка составлена восемью такими же сегментами, полный объем, занимаемый сферами.
3.
внутри ячейки, будет равен 4/Зпа . Таким образом, фактор упаковки для простой кубической решетки можно представить следующими соотношениями: фактор упаковки = объему атомов внутри элементарной ячейки
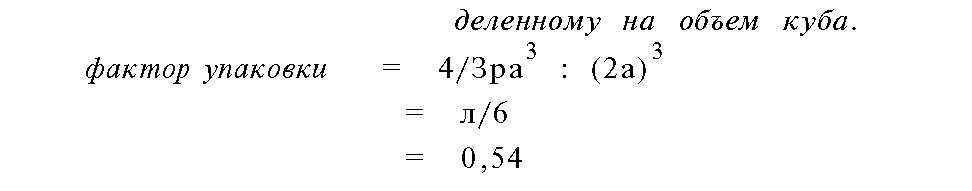
Фактор упаковки 0,54 указывает на то, что почти 50% пространства является незаполненным.
Так как оно пустое, существует возможность заполнения свободного пространства между крупными атомами, атомами малых размеров. Последние будут занимать свободное пространство, не вызывая серьезных нарушений кристаллической структуры. Мы вернемся к этому позже, когда будем рассматривать сплавы. Представив себе большое свободное пространство в этой простейшей структуре, возможно не вызовет удивления то, что существуют другие виды построения атомов, в которых величина фактора упаковки будет большей.
Два таких построения обычно встречаются у металлов, и называются кубической объемноцентрированной (КОЦ) и гранецентрированной (КГЦ) конфигурациями. Эти конфигурации представлены на Рис. 1.3.11. Для КОЦ фактор упаковки составляет 0,68, а для КГЦ — 0,74. Чем выше фактор упаковки, тем труднее малым атомам занять свободное пространство между крупными атомами без повреждения структуры элементарной ячейки.
Заключение.
Существуют три основных группы твердых веществ, строение которых основано на трех типах первичной связи:.
♦ керамика, строение которой основано на ионной связи; керамика может существовать в кристаллической и аморфной формах, керамические материалы в аморфной форме называются стеклами;.
♦ металлы, строение которых основано на металлической связи.
♦ твердые тела, основанные на ковалентной и вто-
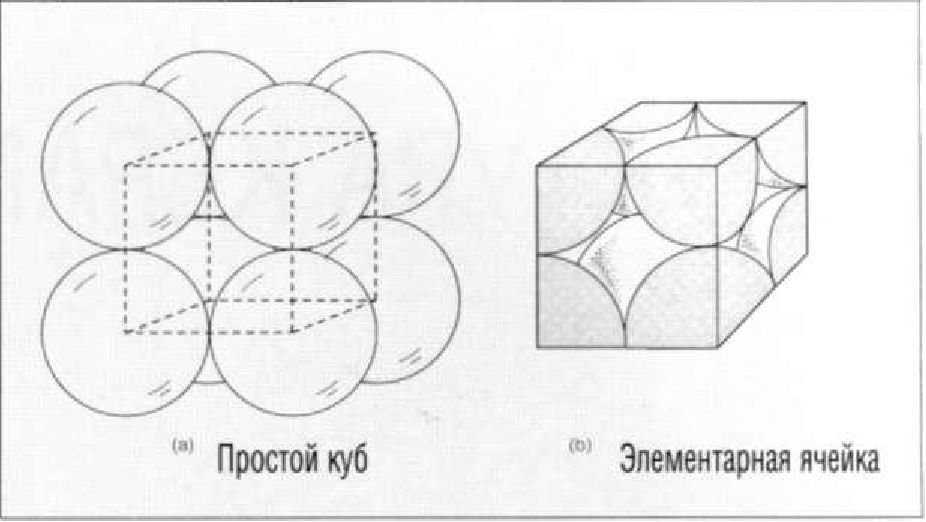
Рис. 1.3.10. Строение простой кубической структуры (а) и вид элементарной ячейки кристаллической решетки такого строения
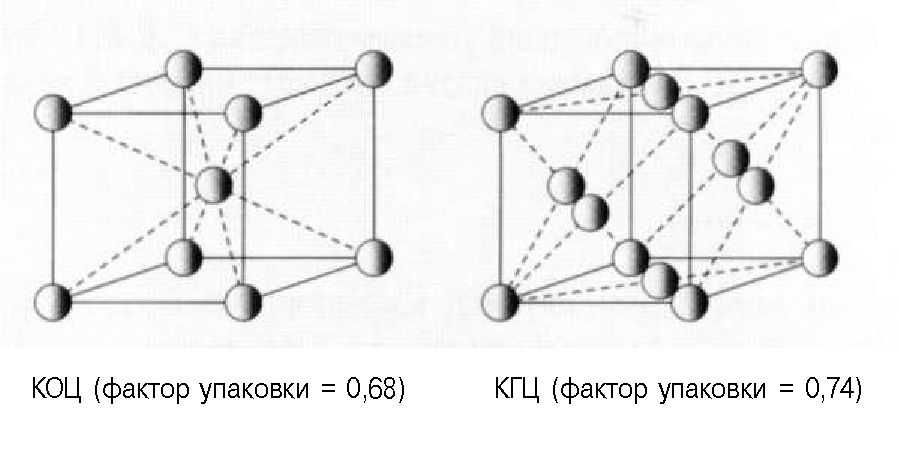
Рис. 1.3.11. Расположение атомов в элементарных ячейках кристаллической решетки кубического объемно центрированного (КОЦ) и кубического гранецентрированного (КГЦ) строения
ричнои связях, включая важнейшие группы материалов, известных под названием полимеры. Существует еще одна важнейшая группа материалов, о которой еще не было упомянуто. Это — композиты, представляющие собой комбинацию двух или большего числа твердых тел. Существует много примеров композитных материалов, как натурального, так и синтетического происхождения. Примерами композитов натурального происхождения являются костные ткани и дентин, состоящие из коллагена (полимера) и апатита (керамического вещества). Примерами композитов синтетической природы могут быть полимеры, армированные стеклянными волокнами, и полимеры, в состав которых входят частицы керамического наполнителя. Применению композитных материалов в стоматологии для реставрации зубов будет посвящена глава 2.2. Другим примером использования структуры композитов являются керметы, которые применяются в качестве наполнителя для изготовления некоторых стеклоиономерных цементов (см. главу 2.3). Название кермет состоит из двух частей: кер, означающей керамику, и мет, которая означает металл.
ВВЕДЕНИЕ.
Керамика представляет собой соединения металлических и неметаллических элементов, и состоит из таких веществ, как оксиды, нитриды и силикаты. Керамические материалы могут быть как кристаллическими, так и аморфными, последняя группа керамики известна под названием стекол.
В керамических материалах отрицательно заряженные ионы (анионы) значительно отличаются размерами от положительно заряженных ионов (катионов). В качестве примера можно привести уже рассмотренный ранее хлорид натрия, имеющий кубическую гранецентрированную структуру. Ионы хлора занимают положения в узлах гранецентрированной решетки, в то время как ионы натрия находятся между ионами хлора, и их место нахождения можно назвать в ну три пространственным расположением. Ионы натрия способны занимать такое положение потому, что они значительно меньше по размеру, чем ионы хлора, и свободно помещаются в оставшемся пространстве элементарной ячейки. Структура хлорида натрия схематически представлена на Рис. 1.4.1. Другим примером структуры этого типа является оксид цинка, который широко используется в стоматологии. Существует много других видов применения неорганических керамических материалов в стоматологии: их используют в качестве наполнителей полимерных композитов, для изготовления стеклоиономерных цементов, формовочных материалов и стоматологических фарфоров.