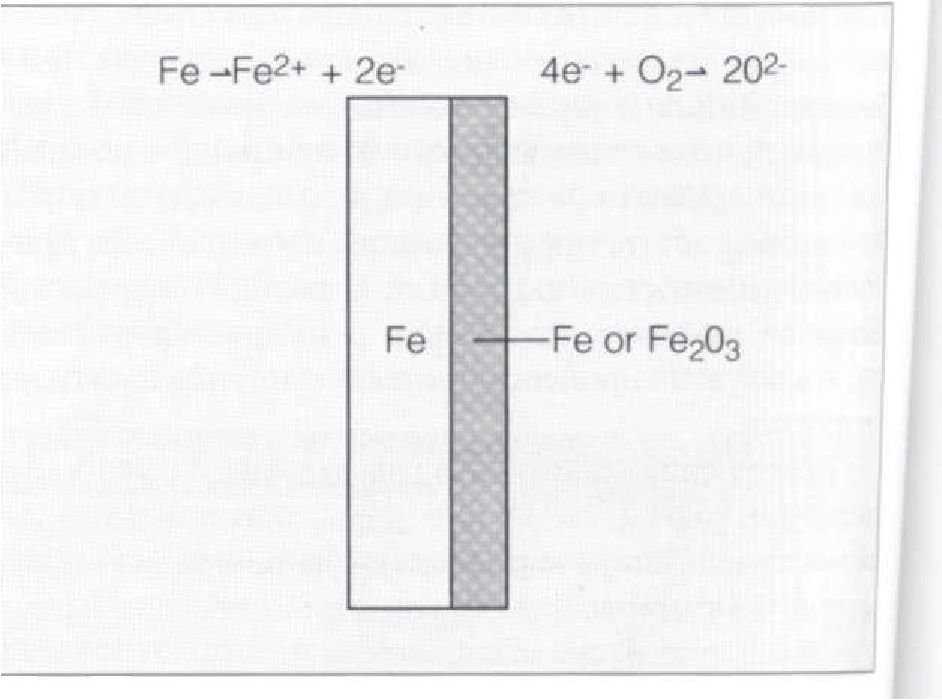
В результате этой реакции металл становится положительно заряженным ионом. Участок, где происходит окисление, называется анодом. Электроны будут перемещаться или станут частью другого химического вещества в результате реакции восстановления. Например, если в растворе кислоты содержится растворенный кислород, то реакцию восстановления можно записать следующим образом:.
02 + 4Н + ->2Н20.
Участок, где происходит восстановление, называется катодом.
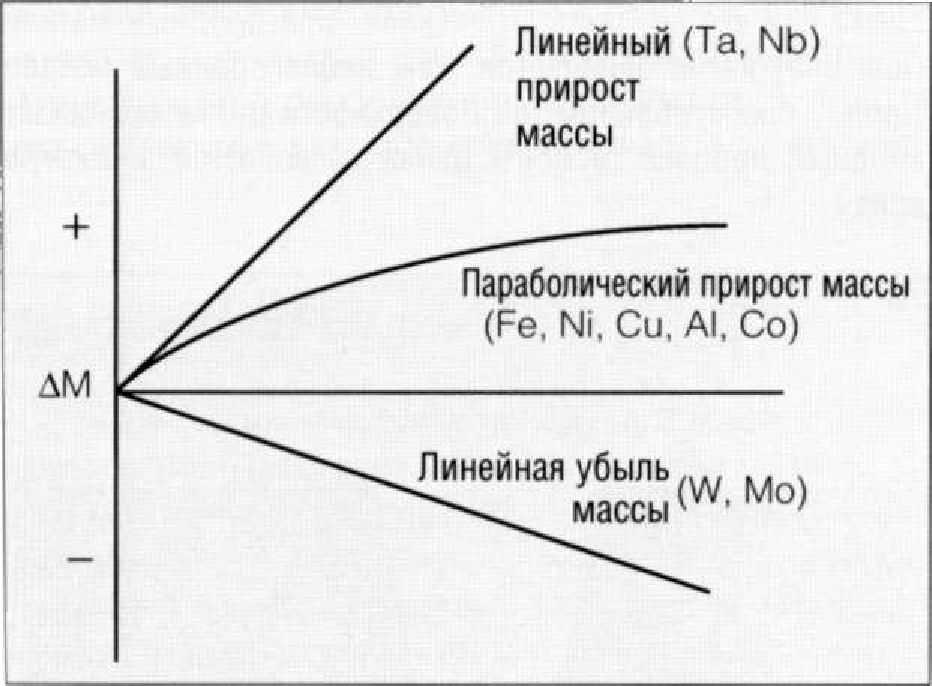
Рис. 1.9.3. Изменение массы металлов при образовании оксидной пленки
Все металлы могут подвергаться коррозии в условиях агрессивной среды. Коррозия металлов — явление весьма нежелательное, поскольку она ослабляет материал и может стать причиной разрушения. Более того, продукты коррозии могут вызвать неблагоприятную реакцию тканей живого организма, как правило, это приводит к ограничению использования металлов для стоматологических целей.
Сухая коррозия.
В отличие от золота и еще нескольких благородных металлов, при контакте с кислородом воздуха на поверхности всех других металлов образуется поверхностная оксидная пленка (Рис. 1.9.2). Иногда эта тонкая поверхностная оксидная пленка хорошо видна, например, на поверхности титана она вызывает интерференцию света. Это свойство оксидной пленки титана используется при изготовлении ювелирных изделий.
Так как образование поверхностного оксидного слоя связано с присоединением к поверхности металла дополнительных атомов кислорода, масса окисляемого материала увеличивается. Этот процесс можно проконтролировать. На Рис. 1.9.3 представлены три возможных результата этого эксперимента. В каком направлении будет протекать реакция окисления, зависит от стабильности образующейся оксидной пленки.
Если оксидная пленка обладает высокой стабильностью, происходит самоограничение процесса коррозии за счет того, что в некоторой точке ионам металла придется настолько долго диффундировать к поверхности сквозь толщу оксидной пленки, чтобы вступить в химическую реакцию с кислородом, что процесс приостанавливается. В таких случаях быстрый поначалу набор массы постепенно замедляется, а кривая изменения массы в зависимости от времени окисления будет иметь параболический характер.
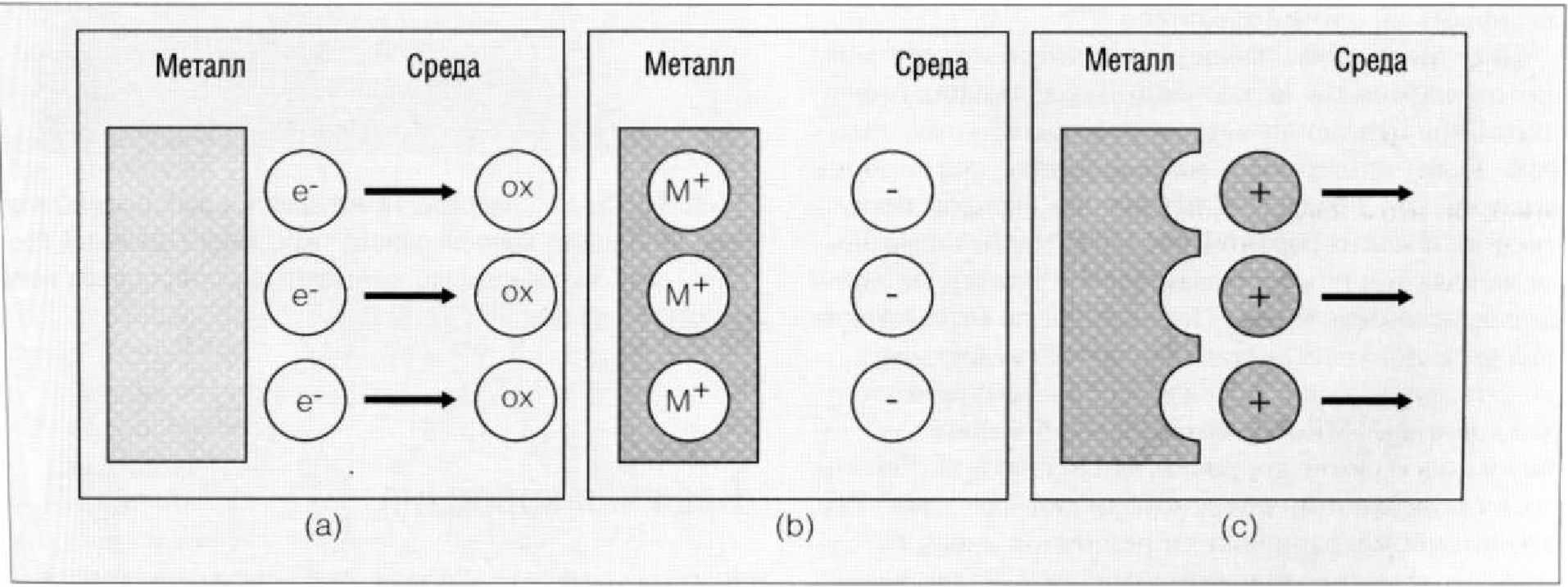
Рис. 1.9.4. Окисление металла в водной среде. Окислитель забирает электроны с металлической поверхности в процессе (а), называемом катодным. В результате металл становится положительно заряженным (Ь). Благодаря положительному заi с поверхности металла выделяются металлические ионы, этот процесс называется анодным (с)
В других случаях оксидная пленка не обладает высокой стабильностью. Она растрескивается на поверхности металла или отслаивается, что приводит к обнажению чистого металла и образованию нового оксидного слоя. В таких случаях количество оксида металла будет постепенно увеличиваться, а кривая будет носить линейный характер.
В третьем случае наблюдается потеря массы металла, что встречается не так часто. Такое явление наблюдается при окислении металла при высоких температурах. Если температура нагрева будет достаточной высокой, это приведет к испарению оксидов металла сразу же после их образования. При этом на поверхности металла будет отсутствовать барьер, препятствующий дальнейшей окислению. Постепенно, по мере испарения оксидного слоя, металл будет терять свою массу.
Эти формы окисления металлов называются сухой коррозией. Многие металлы обладают устойчивостью к сухой коррозии за счет возникновения на их поверхности защитного оксидного слоя. Так, военные бомбардировщики резервной авиации хранятся в пустыне, где жарко, но, что более важно, очень сухо. Автомобили в жарком и сухом климате также меньше подвержены коррозии. Однако в присутствии влаги реакция металла на кислород существенно меняется.
Влажная коррозия
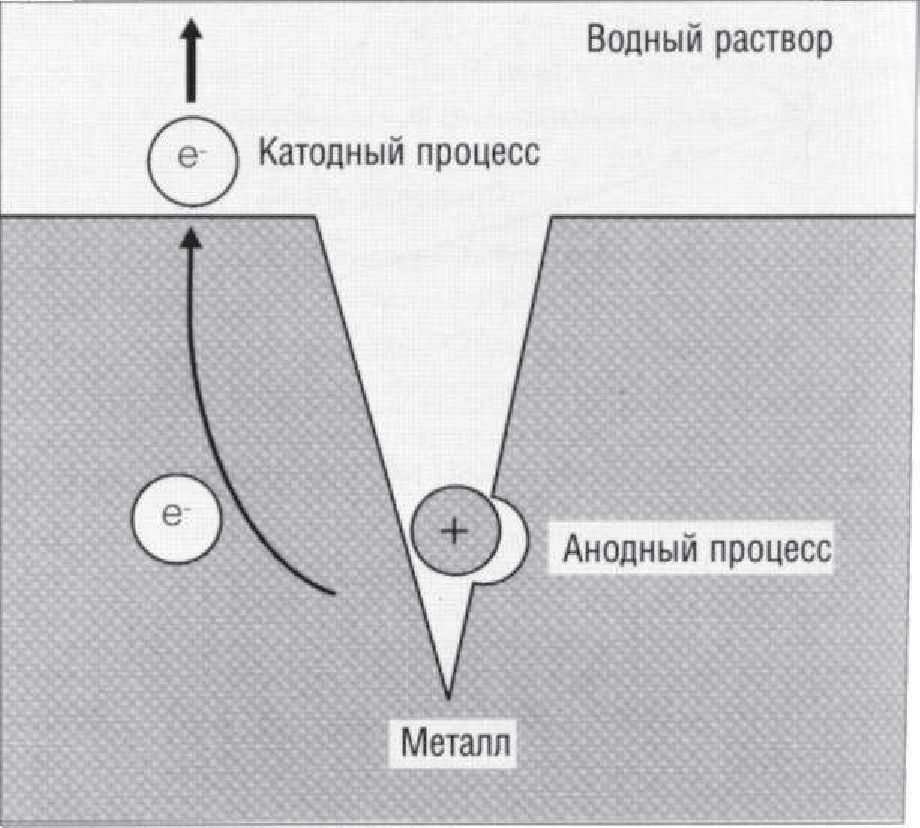
Рис. 1.9.6. На поверхности металла вокруг трещины возникает процесс коррозионного окисления (катодный процесс), а в самой трещине начинают высвобождаться ионы (анодный процесс)
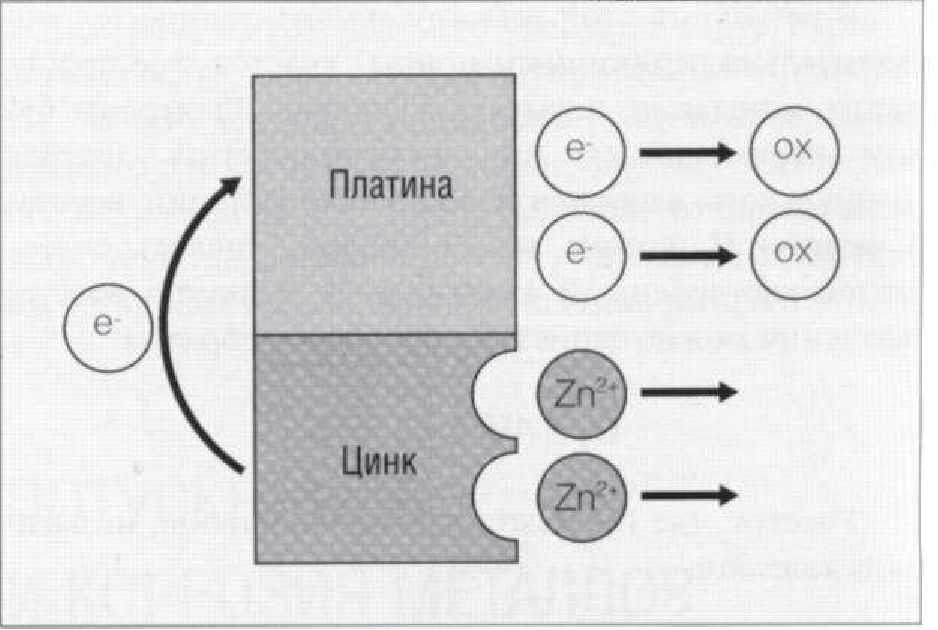
Рис. 1.9.5. Схема процесса гальванической коррозии цинка при его контакте с платиной. Благородный металл (платина) легче окисляется, чем неблагородный металл (цинк), таким образом, на поверхности цинка возникает анодный процесс, и ионы цинка выделяются в водную среду
Влажная коррозия может наблюдаться в нейтральной, кислой или щелочной среде. Когда металл помещают во влажную среду, ионы металла и его электроны выходят в воду (Рис. 1.9.4). Окислитель, кислород, растворенный в воде, оттягивает электроны от металла. Это явление называется катодным процессом. Потеря металлом электронов ведет к тому, что металл приобретает положительный заряд. Положительные ионы начинают выходить с поверхности металла в воду, что приводит к возникновению анодного тока.
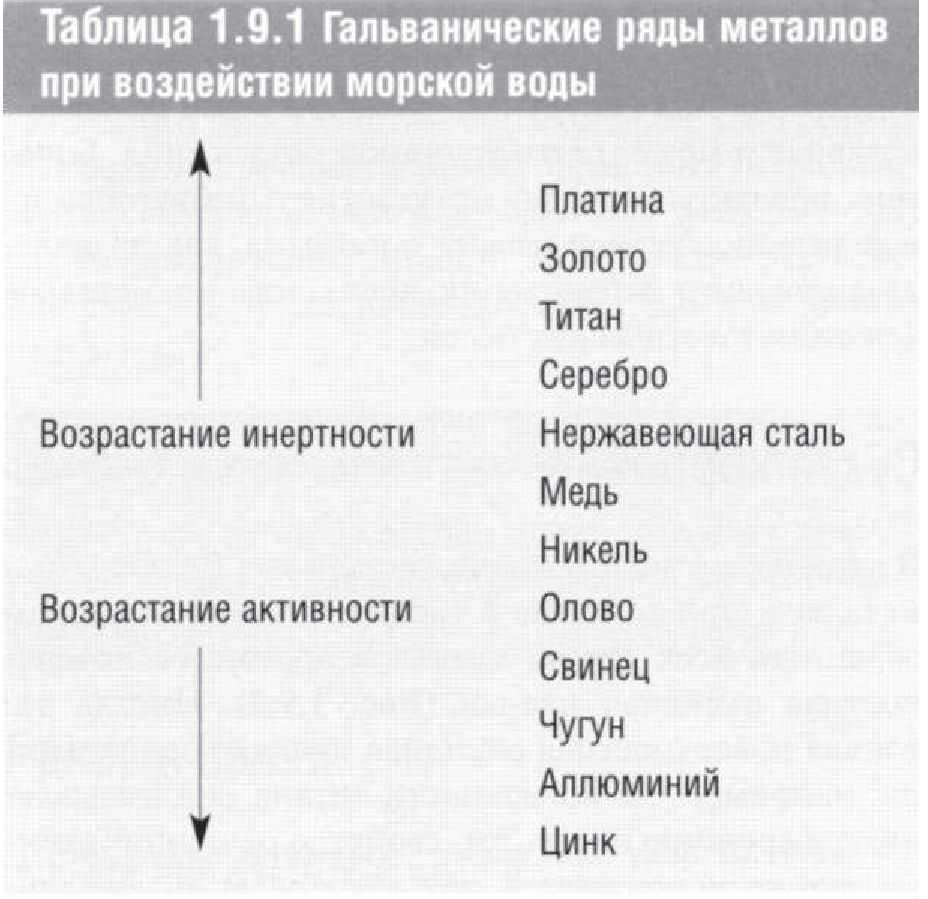
Разные металлы имеют разную устойчивость к окислению во влажных средах. Относительная реакционная способность металлов называется гальваническим рядом. В Таблице 1.9.1 представлен гальванический ряд металлов, погруженных в морскую воду. Наиболее инертные металлы находятся в верхней части этого ряда. Если выход ионов одинаков по всей поверхности металла, то процесс называют равномерной коррозией. Однако, большую опасность представляет локализованная (местная) коррозия, которая при определенных условиях развивается на отдельных участках металлической поверхности. Примерами локализованной коррозии являются электрохимическая (гальваническая) и щелевая коррозии.
Гальваническая коррозия.
Гальваническая коррозия возникает при соединении двух разнородных металлов. Это приводит к тому, что коррозия одного из этих металлов значительно усиливается.
Классическим примером гальванической коррозии является коррозия цинка в кислоте. Если цинк находится в гальванической паре с платиной, как показано на Рис. 1.9.5, то платина начинает быстро реагировать на ионы водорода, находящиеся в кислоте, и высвобождать электроны. В результате присоединения электронов к ионам водорода образуется газ водород (этот процесс является классическим примером катодного процесса). Между цинком и платиной возникает электрический дисбаланс. Электроны начинают переходить от цинка к платине. Этот переход приводит к образованию ионов цинка (анодный процесс), и цинк, находящийся в контакте с платиной, начинает быстро разрушаться в результате коррозии. Степень, в которой разнородные металлы подвержены этой форме коррозии, зависит от относительной скорости их окисления. В частности, платина является эффективным окислителем. У других благородных металлов этот эффект будет менее выраженным, поэтому они не будут столь эффективными окислителями, как платина.
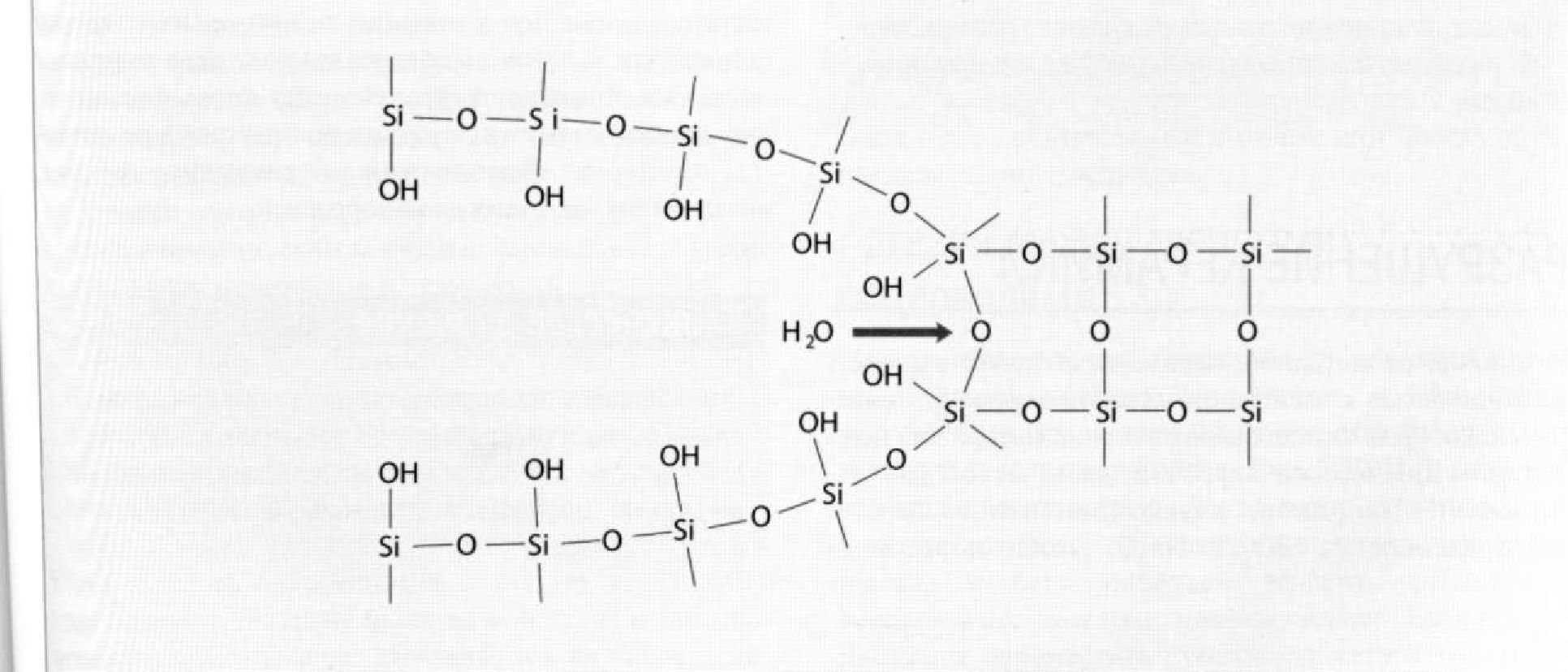
Рис. 1.9.7. Распространение или рост трещины в керамике в результате локального гидролиза в острие трещины
Сочетание двух разнородных металлов, ведущих себя подобно тому, как было описано выше, называется гальванической ячейкой. Гальваническая ячейка может возникать и в пределах одного сплава, если в его составе присутствует фаза, скорость окисления которой отличается от скорости окисления основного (доминирующего) компонента. Примером гальванической ячейки является взаимодействие между фазами у, и у
2
в стоматологической амальгаме, где фаза у
2
корродирует значительно быстрее, чем фаза у,.